9月29日,美国食品药品监督管理局(FDA)宣布批准Amylyx公司研发的新药Relyvrio(此前为AMX0035)上市,用以治疗成人肌萎缩侧索硬化症(amyotrophic lateral scle rosis, ALS)。Relyvrio可单独使用,也可与现有药物组合使用。它是FDA批准的第三款ALS治疗药物,也是首个既能显著减缓疾病进展与功能衰退,又能增加患者生存时间的疗法。
ALS是一种由脑和脊髓中运动神经元坏死导致的进行性神经退行性疾病。随着病程进展,患者的肌肉功能将严重受损,运动、讲话和呼吸能力逐渐丧失,最后多因呼吸衰竭死亡。流行病学研究表明,10万人中每年会有1-2.6人患ALS,患者平均58-60岁,患病后的生存时间仅为3-4年。
由于患病人数少,发病机制不明,动物疾病模型缺失等原因。针对ALS的新药开发长期停滞不前。近年来,随着市场的增长和“冰桶挑战”等热点事件的出现,业界对ALS的兴趣逐年增加。
然而到目前为止,能治愈ALS的特效药尚未出现。此前,FDA仅批准过两款用于治疗ALS的药物——1995年上市的利鲁唑和2017年上市的依达拉奉。前者可延长患者生存时间,后者虽然因其改善运动功能的效果在美国上市,但由于实验设计和数据方面的问题未被欧洲批准使用。因而,全球逾20万患者亟待新药物的问世。
Relyvrio是由苯丁酸钠(sodium phenylbutyrate)和牛磺酸二醇(taurursodiol)组成的复方口服制剂。现有假说认为它可通过减轻内质网应激和线粒体功能紊乱,减少神经元的死亡,从而发挥治疗ALS的作用。
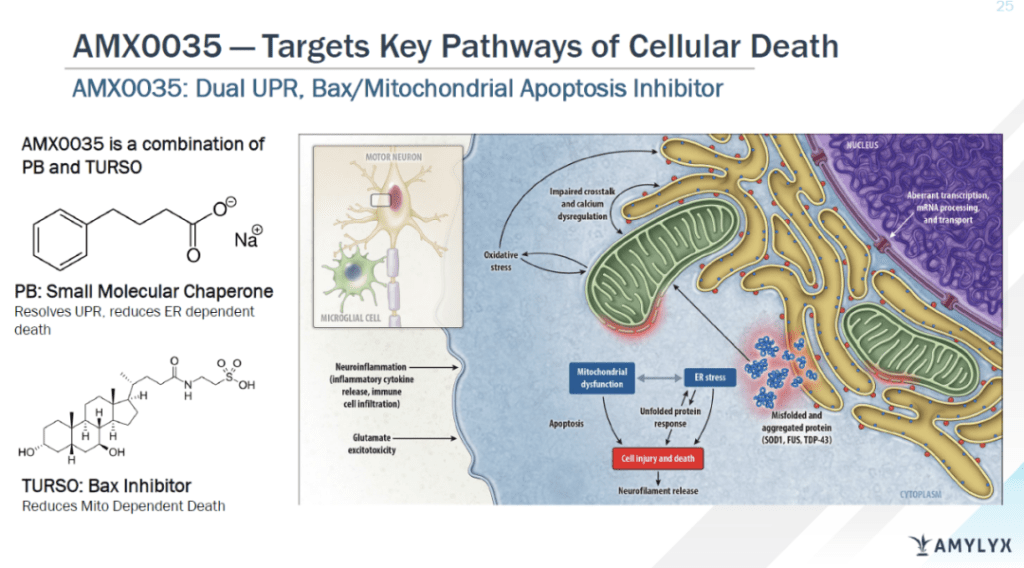
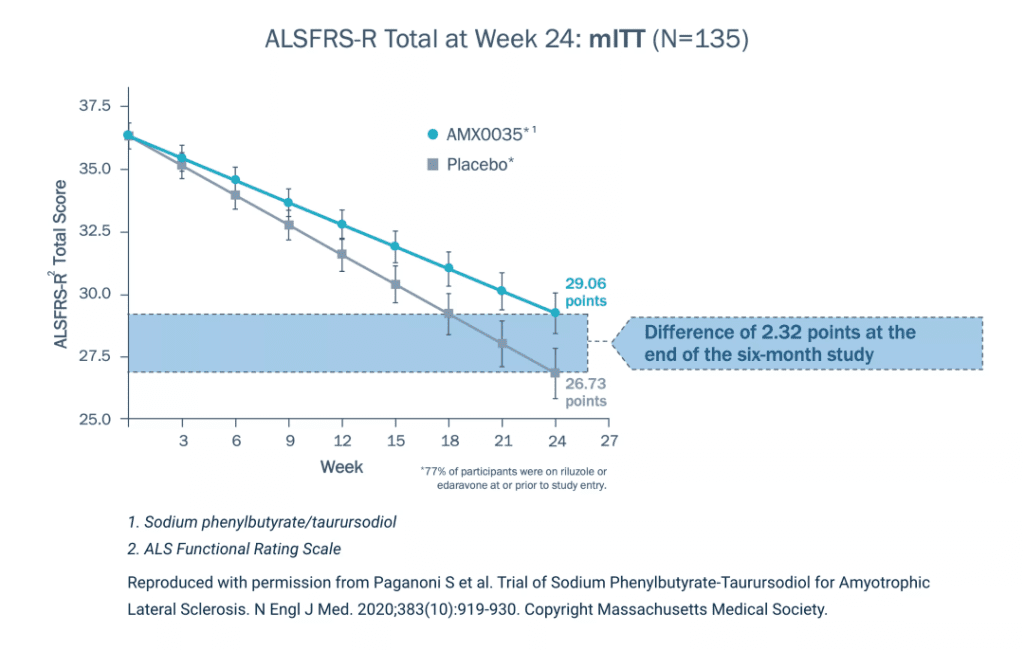
在2017年发起的多中心II期临床试验CENTAUR中,研究者招募了137位ALS患者参加为期6个月的安慰剂对照随机试验,其后又开展了开放标签延长试验。服药组每次服用3克苯丁酸钠与1克牛磺酸二醇,前三周每天一次,之后每天两次。试验结果表明,患者在标准疗法的基础上服用Relyvrio可显著减缓ASL引发的运动功能下降:以修订版肌萎缩侧索硬化症功能评定量表(Amyotrophic Lateral Sclerosis Functional Rating Scale – Revised,ALSFRS-R)为标准,服药组ALSFRS-R分数平均每月降低1.24,而安慰剂组每月降低1.66,24周时服药组总分比安慰剂组高2.32分,达到了临床主要终点;次要终点的数项指标组间差异均不明显;不良反应多为腹泻、腹痛、恶心、上呼吸道感染和胃肠道不适。
正在进行的III期试验,PHOENIX预计将招募600名患者,在为期48周的随机、安慰剂对照试验中进一步评价Relyvrio治疗ALS的安全性与有效性。主要药效评价指标为试验过程中ALSFRS-R评分的变化和患者生存情况。Amylyx计划在2024年完成PHOENIX试验并公布试验结果。
基于CENTAUR结果,2021年12月FDA接受了Amylyx的新药上市申请并将其列为优先评审药物。根据处方药使用者费用法案(Prescription Drug User Fee Act,PDUFA),FDA将于今年6月29日前宣布结果。但好景不长,2022年3月,FDA组织的第一次外周与中枢神进系统药物咨询委员会(Peripheral and Central Nervous System Drugs Advisory Committee,PCNSDAC)评审会议上,专家组以6:4的投票结果表达了对Relyvrio的临床试验规模小,数据缺失,统计方法适用性等问题的质疑。
但基于同样的数据,加拿大监管部门却在6月有条件地批准了Relyvrio以商品名Albrioza上市,用以治疗ALS。同月,FDA宣布将延迟三个月,在9月29日前公布评审结果。
针对第一次PCNSDAC的投票结果,Amylyx重新分析了CENTAUR试验中被试的生存数据,并与Relyvrio在另一项针对阿尔茨海默病的II期临床试验中的生物标志物数据一起提交给FDA再次评议。在9月7日的第二次PCNSDAC会议上,专家们却推翻了第一次的结论,以7:2的投票结果认可现有证据足以支持Relyvrio的新药申请。
9月29日,Amylyx在万众瞩目下宣布Relyvrio获得了FDA的批准上市,并于9月30日召开了媒体发布会。目前,Relyvrio可单独使用,也可辅以现有疗法共同治疗成人ALS。
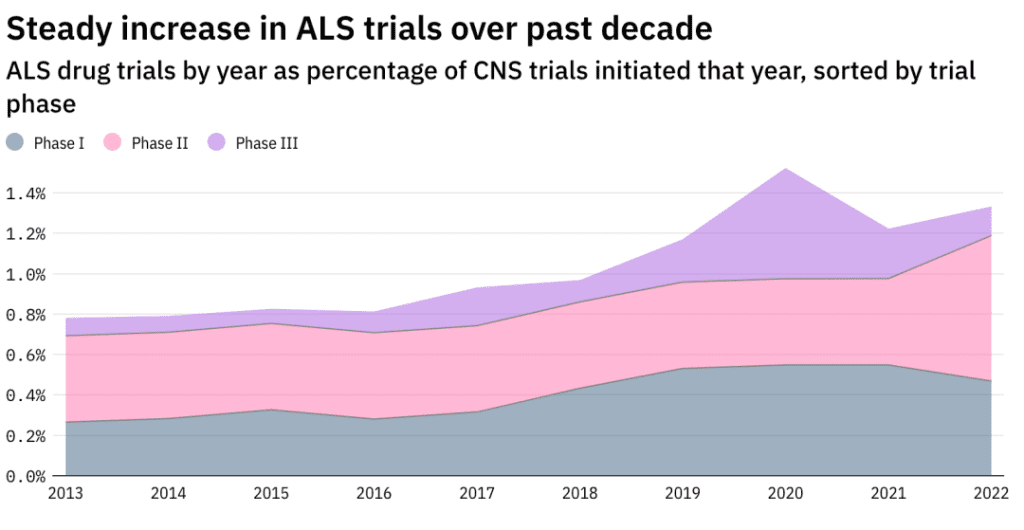
近年来,随着ALS通过社交媒体逐步进入大众视野,业界对于ALS新药研发的热情也逐渐高涨。2013年以来,针对ALS的临床试验占中枢神经系统药物临床试验的比例攀升了约70%。但2017年以来,只有Relyvrio成功上市。
在发布会中,Amylyx将Relyvrio定价为每年158000美元(稍低于每年169000美元的依达拉奉),并计划通过Amylyx医疗团队支持项目(Amylyx Care Team Support Program)为有意开具Relyvrio处方的医生和ALS患者提供支持。
虽然Relyvrio目前的受众局限于美国、加拿大和欧盟的6万ALS患者,但根据投资银行SVB Securities分析师的预测,Relyvrio将在2026年前为目前尚未盈利的Amylyx带来16亿美元的收入。同时,除了治疗相对罕见的ALS,Amylyx也在开发Relyvrio治疗阿尔茨海默症等其它神经退行性疾病的潜力,若确证有效,其市场前景将迎来数倍增长。
参考资料
- Amylyx press release: Amylyx Pharmaceuticals Announces FDA Approval of Relyvrio™ for the Treatment of ALS
- Talbott, Evelyn O., Angela M. Malek, and David Lacomis. “The epidemiology of amyotrophic lateral sclerosis.” Handbook of clinical neurology 138 (2016): 225-238.
- Van Es, Michael A., et al. “Amyotrophic lateral sclerosis.” The Lancet 390.10107 (2017): 2084-2098.
- Paganoni, Sabrina, et al. “Trial of sodium phenylbutyrate–taurursodiol for amyotrophic lateral sclerosis.” New England Journal of Medicine 383.10 (2020): 919-930.








