2022年6月16日,罗氏与班纳阿尔茨海默病研究所(Banner Alzheimer’s Institute,BAI)联合宣布,抗β淀粉样蛋白(Amyloid β,Aβ)单克隆抗体crenezumab在预防常染色体显性遗传阿尔茨海默病(Autosomal Dominant Alzheimer’s Disease,ADAD)的临床II期试验API ADAD中未能达到主要终点。该结果对以Aβ为靶点的阿尔茨海默病(Alzheimer’s Disease,AD)新药研发造成严重打击,当天下午罗氏股价应声下跌超1%。
AD是一种以记忆力衰退和认知功能下降为主要临床表现的神经退行性疾病,目前全球约有3000-3500万患者。随着病程进展,患者逐渐失去行为能力,给家庭和社会带来沉重的负担。但遗憾的是AD的病因尚未完全探明,目前也不存在有效的治疗手段。
大量沉积的淀粉样斑块是AD患者大脑中最明显病理改变之一。围绕淀粉样斑块及其主要成分Aβ,有学者提出若干假说,认为它们是造成AD的主要原因。其中,“淀粉样蛋白级联假说”指出,Aβ聚合形成的不溶性淀粉样斑块通过细胞毒作用损害神经元诱发了AD。然而在临床试验中,数款能清除Aβ的候选药物却未能带来有效的认知改善,加之有研究发现认知衰退早在斑块形成之前便已出现,“淀粉样蛋白级联假说”因此备受质疑。在此基础上,学者又提出“Aβ寡聚体假说”,认为聚合度较低的Aβ寡聚体而非高聚合度的淀粉样斑块才是导致AD的元凶。
尽管饱受争议,美国国家老年研究所和阿尔茨海默病协会提出的AD诊断“金标准”ATN认为,无论有无临床症状,只要检出Aβ即可判定进入了AD病程。2018年2月,美国食品药品监督管理局(Food and Drug Administration,FDA)发布的AD新药研发行业指南也支持将包括Aβ在内的生物标志物水平变化作为检验药效的指标之一。加之近20年来唯一获FDA批准上市的aducanumab也是通过与Aβ寡聚体结合后将其清除来达到疗效,故而,Aβ目前依然是抗AD新药研发最关注的靶点之一。目前临床在研的143款候选药物中,有16款针对Aβ开发,其中又有6款单克隆抗体进入过临床II期试验。
Crenezumab的开发历程
Crenezumab是在其鼠源前体IgG4骨架上改造而得的人源单克隆抗体,可特异性结合Aβ第13-24位氨基酸残基,对Aβ十六聚体组装形成的纤维和Aβ五聚体有较强的亲和力,能阻断Aβ的聚集并促进其降解。在小鼠AD模型中,crenezumab可使脑内淀粉样斑块缩小,且安全性良好。
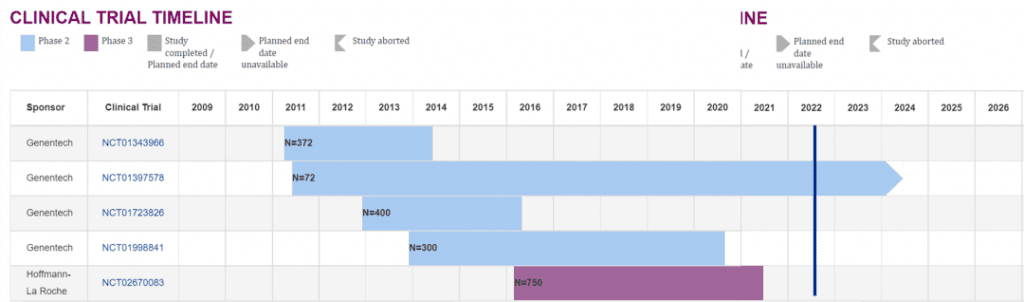
Crenezumab最初由瑞士药企AC Immune开发,后在2006年由美国公司Genentech接手。2009年,罗氏以470亿美元的价格收购了Genentech,获得了crenezumab的开发权。问世至今,crenezumab参加过8场临床试验。
在首先开展的两项I期试验中,健康志愿者和AD患者中仅有小部分出现无症状的轻微脑出血,且无血管源性脑水肿发生,说明crenezumab较同类其它单抗安全性良好,为后续试验剂量的确定奠定了基础。
为了评估crenezumab对轻至中度AD的疗效,II期试验ABBY招募了450名患者,每月皮下注射15mg/kg,73周后的结果表明试验未能在ADAS-Cog和CDR-SB两项量表上达到主要终点,但可能对轻度AD患者存在疗效。另一项91人参加的II期试验BLAZE同样未能达到降低Aβ的主要终点,但达到了降低脑脊液Aβ寡聚体的次要终点。为提升剂量以增强药效,Genentech在2015年2月开展了一项72位AD患者参与的Ib期试验,次年公布的数据表明每月静注60mg/kg可产生更强的疗效。
针对更为早期的AD,2015年7月开始的III期试验CREAD在233个区域招募了750位Aβ阳性的轻度认知障碍或前驱期AD患者,每月注射60mg/kg,以CDR-SB量表为主要终点,其它认知和功能指标为次要终点,评估crenezumab的疗效。2017年2月,Genentech又在750位前驱期到轻度AD患者中开展了第二项III期试验CREAD2。然而在2019年1月,罗氏提前终止了CREAD与CREAD2,并在3月的阿尔茨海默病与帕金森病国际会议上宣布,两项试验中治疗组所有指标较安慰剂组均无显著差异。
API ADAD试验
ADAD是由APP、PSEN1或PSEN2基因中的突变导致的家族性AD。虽然仅有不到1%的AD为ADAD,但与发病较晚的散发性AD不同的是,绝大多数携带者会在30-60岁之间出现认知下降,且有50%的概率遗传给子女。因而,ADAD会给家庭造成更大的冲击。
世界上最大的ADAD家族生活在哥伦比亚,其六千多成员中约有1200人携带PSEN1 E280A突变,他们平均在44岁发病,并在49岁时发展为痴呆。为了摆脱ADAD的厄运,该家族的252位成员参加了API ADAD试验。
阿尔茨海默病预防计划(Alzheimer’s Prevention Initiative,API)是BAI与美国国立老龄研究所(National Institute on Aging,NIA)合作开展的旨在推进科学研究与药物开发以预防AD的计划。作为API的一部分,API ADAD首先由BAI提出,在BAI、NIA和罗氏的合作下完成,是美国国立卫生研究院(National Institutes of Health,NIH)资助的首项在已知风险人群中预防认知下降的临床试验。
API ADAD是一项前瞻性、随机、双盲、平行组、安慰剂对照II期临床试验,旨在评价crenezumab在PSEN1 E280A突变携带者中预防认知下降的效果。试验将2/3携带突变的参与者按1:1随机分配到crenezumab治疗组或安慰剂组之中,分别接受至少260周的治疗。在试验开始的2013年,给药剂量为每两周皮下注射300mg,2015年调整为每两周皮下注射720mg,到了2019年,被试可选择将剂量提升至每四周静脉注射60mg/kg。剩下1/3不携带突变的参与者仅注射安慰剂。试验以API ADAD复合认知量表评分与检测情景记忆的任务延迟自由线索回忆测试(Free and Cued Selective Reminding Test,FCSRT)中的表现为主要终点,辅以安全性、脑脊液与脑影像生物标志物为次要终点评价疗效。
然而,这场为期九年的实验的结果却不尽如人意。2022年6月16日,罗氏与BAI联合宣布,虽然在多项指标上治疗组有向好趋势,但与安慰剂组无显著差异,接受crenezumab治疗并不能延缓认知下降与情景记忆衰退,API ADAD未能达到任意一项主要终点。进一步的数据分析结果将于2022年8月2日召开阿尔茨海默病协会国际会议上公布。

新药研发前路漫漫
据统计,一名AD患者带来的年均医疗成本为3-6万美元,全球每年有8000亿美元花费在AD诊疗上,超过各国GDP总和的1%。如此庞大的市场引得各大药企争相投入到抗AD的新药研发之中。但遗憾的是,近二十年的时间里只有aducanumab一款药物在巨大争议中获得FDA批准。
2021年6月7日,FDA不顾独立委员会10票反对1票弃权的反对意见,在需要后续实验确证的前提下批准了同为抗Aβ单抗aducanumab在美国上市,用以治疗所有类型AD。但在7月8日FDA旋即将适应症修改为“MCI与轻度AD”。今年1月,美国医疗保险和医疗补助服务中心(Centers for Medicare & Medicaid Services,CMS)又将其保险覆盖范围限制为“参加严格临床试验的患者”。由于实际效果尚存争议、脑水肿等副反应频发,aducanumab不仅销售惨淡,遭渤健降价处理,更被EMA和PMDA拒绝在欧洲和日本上市。
Crenezumab在API ADAD试验中的失败、aducanumab差强人意的市场表现以及其他抗Aβ单抗同样曲折的研发历程让人们不得不再度回过头来审视Aβ与AD之间的关系。
一方面,以Aβ为靶点的候选药物在临床试验中接连的失败,让人不禁质疑Aβ与认知衰退之间的因果关系是否被颠倒。2022年6月2日发表于《自然-神经科学》的研究也提出是AD中的自噬溶酶体酸化障碍导致了Aβ的形成,而非后者促进了AD的发生。另一方面,导致ADAD发病的三个基因却都是Aβ生成通路中关键基因,而且AD临床试验复杂多变,干预时间过晚、给药剂量不够、量表评分主观性强都可能影响实验结果,实验失败不一定是因为找错了靶点。Aβ在AD中扮演的角色远比我们想象的更加复杂。
目前,抗AD新药研发仍在如火如荼地进行之中,靶点从传统的Aβ、Tau到神经再生、氧化应激等遍地开花,学术界也在病理机制研究、新靶点的发现和创新治疗手段的探索中不断取得突破。希望在不久的将来,我们会迎来一款能够有效治疗AD的“重磅炸弹”。
参考文献
- Media Release: Roche provides update on Alzheimer’s Prevention Initiative study evaluating crenezumab in autosomal dominant Alzheimer’s disease https://www.roche.com/media/releases/med-cor-2022-06-16
- Cacabelos, Ramón. “What have we learnt from past failures in Alzheimer’s disease drug discovery?.” Expert Opinion on Drug Discovery 17.4 (2022): 309-323.
- Cummings, Jeffrey, et al. “Alzheimer’s disease drug development pipeline: 2022.” Alzheimer’s & Dementia: Translational Research & Clinical Interventions 8.1 (2022): e12295.
- Guthrie, Heather, et al. “Safety, tolerability, and pharmacokinetics of crenezumab in patients with mild-to-moderate Alzheimer’s disease treated with escalating doses for up to 133 weeks.” Journal of Alzheimer’s Disease 76.3 (2020): 967-979.
- Cummings, Jeffrey L., et al. “ABBY: A phase 2 randomized trial of crenezumab in mild to moderate Alzheimer disease.” Neurology 90.21 (2018): e1889-e1897.
- Salloway, Stephen, et al. “Amyloid positron emission tomography and cerebrospinal fluid results from a crenezumab anti-amyloid-beta antibody double-blind, placebo-controlled, randomized phase II study in mild-to-moderate Alzheimer’s disease (BLAZE).” Alzheimer’s research & therapy 10.1 (2018): 1-13.
- Adolfsson, Oskar, et al. “An effector-reduced anti-β-amyloid (Aβ) antibody with unique aβ binding properties promotes neuroprotection and glial engulfment of Aβ.” Journal of Neuroscience 32.28 (2012): 9677-9689.
- Ultsch, Mark, et al. “Structure of crenezumab complex with Aβ shows loss of β-hairpin.” Scientific reports 6.1 (2016): 1-11.
- Fuller, James P., et al. “Comparing the efficacy and neuroinflammatory potential of three anti-abeta antibodies.” Acta Neuropathologica 130.5 (2015): 699-711.
- Yoshida, Kenta, et al. “Pharmacokinetics and pharmacodynamic effect of crenezumab on plasma and cerebrospinal fluid beta-amyloid in patients with mild-to-moderate Alzheimer’s disease.” Alzheimer’s Research & Therapy 12.1 (2020): 1-12.
- Rios‐Romenets, Silvia, et al. “Baseline demographic, clinical, and cognitive characteristics of the Alzheimer’s Prevention Initiative (API) Autosomal‐Dominant Alzheimer’s Disease Colombia Trial.” Alzheimer’s & Dementia 16.7 (2020): 1023-1030.
- Lee, Ju-Hyun, et al. “Faulty autolysosome acidification in Alzheimer’s disease mouse models induces autophagic build-up of Aβ in neurons, yielding senile plaques.” Nature Neuroscience (2022): 1-14.
- Rabinovici, Gil D. “Controversy and progress in Alzheimer’s disease—FDA approval of aducanumab.” New England Journal of Medicine 385.9 (2021): 771-774.








